2026年2月3日,ky开元集团陈庆锋课题组联合国内多个课题组在国际著名期刊《Nature Communications》杂志(IF=15.7)在线发表题为“ Molecular mechanism of phosphate import by the bacterial PstSCAB transporter ”的研究论文。该研究通过冷冻电镜技术解析了细菌磷酸盐(Pi)内运蛋白复合物PstSCAB在静息态、前转运态和催化中间态的三维结构,并结合体外转运实验和计算生物学等手段为深入理解细菌的Pi摄取机制奠定了基础,并为开发以PstSCAB为靶点的病原菌感染干预手段提供了结构依据。

磷作为细胞内第五大丰富元素,是所有生命体不可或缺的营养物质,其调控失衡关乎人类疾病、农业产能及微生物存活,兼具医学、农业与药物研发价值。无机磷酸盐(Pi)是环境中磷的主要存在形式,大肠杆菌中存在低亲和力PiT 系统与高亲和力Pst系统负责Pi摄取,PstSCAB 作为 Pst 系统的核心ABC转运蛋白,受双组分调控系统介导的Pho调控子调控,仅在磷限制条件下激活,其构象变化或为调控信号,且与同操纵子的PhoU密切相关。PstSCAB功能异常会破坏Pho调控子对群体感应、毒素分泌等毒力基因的调控,显著削弱病原菌的毒力,是潜在的药物靶点。该转运蛋白复合物由周质亚基PstS(捕获并递送Pi)、PstA/PstC形成的跨膜结构域(TMD)及PstB胞质亚基(水解ATP供能)组成,尽管PstS的结构研究已较为深入,但PstSCAB完整复合物不同功能状态的结构与Pi转运分子机制仍不明确,导致多个关键科学问题尚未解决:完整蛋白复合物如何组装?跨膜结构域中磷酸盐的结合与特异性识别是如何实现的?磷酸盐的摄取过程需要哪些构象变化?
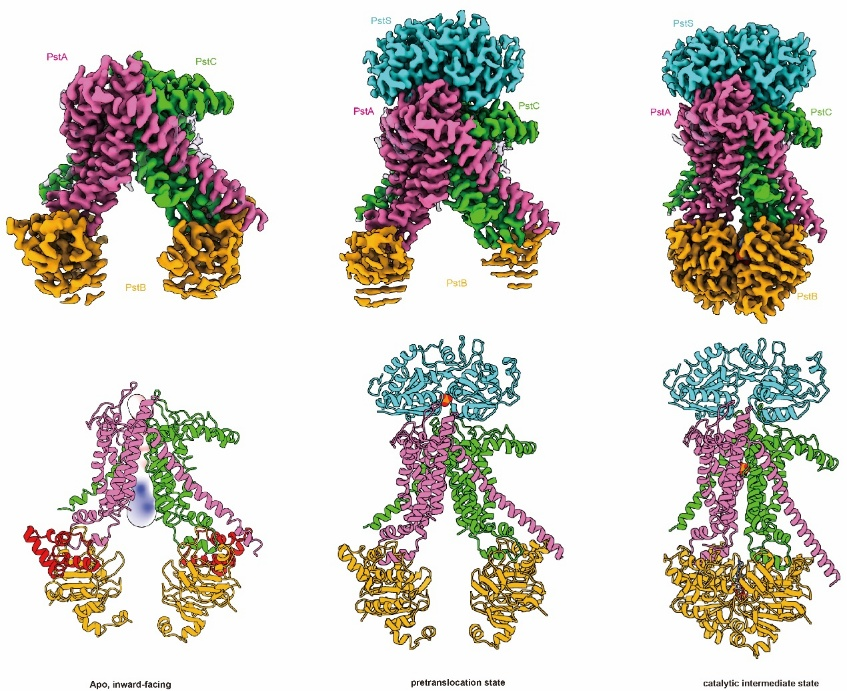
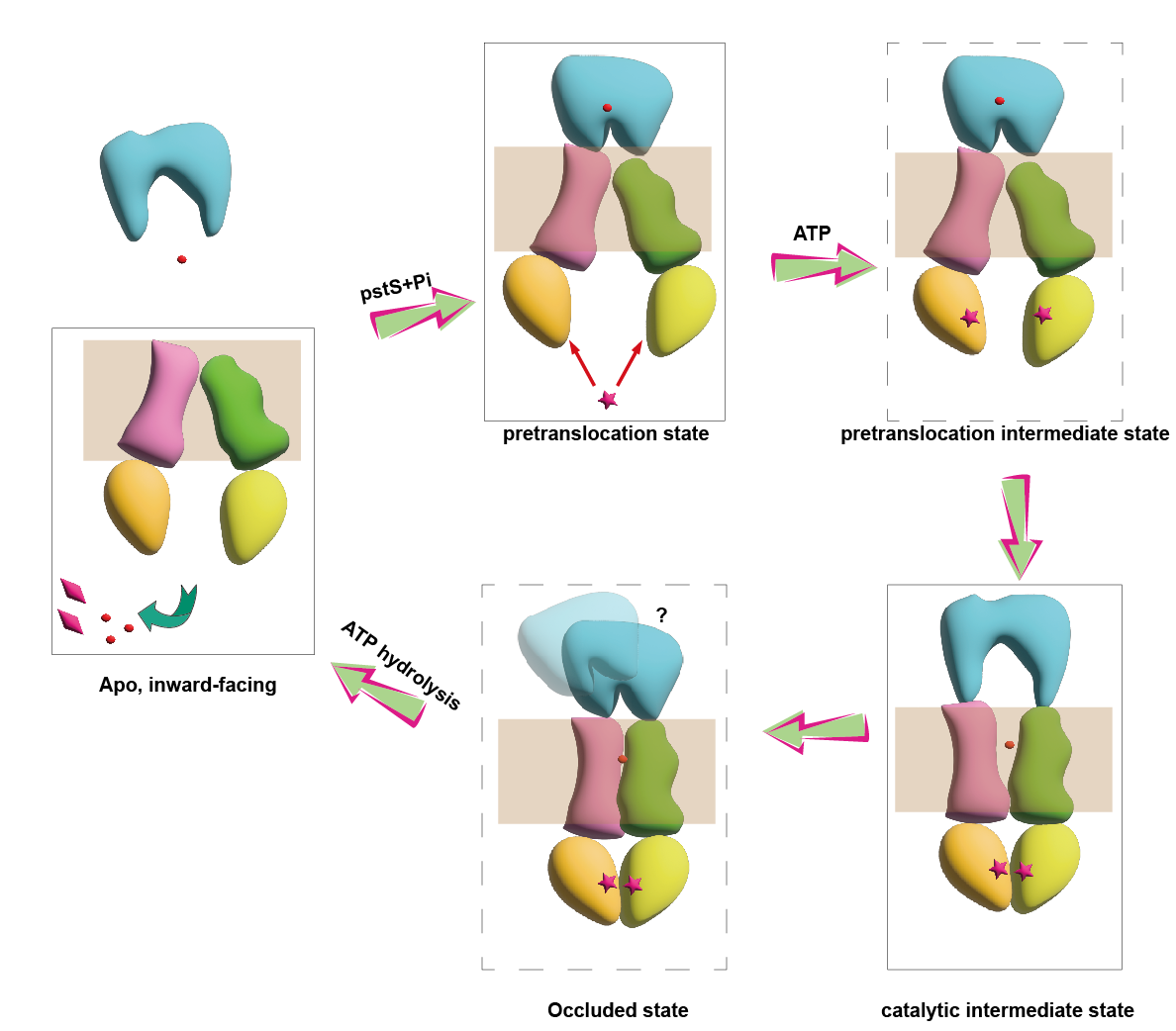
本研究通过冷冻电镜解析了PstSCAB在静息态、前转运态及催化中间态的三维结构,这些结构表明,PstS 亚基的构象变化与PstB亚基的ATP结合/释放过程,共同诱导跨膜结构域发生刚体运动,进而使PstSCAB呈现出朝内或朝外的构象。在跨膜结构域内,磷酸盐由带正电的氨基酸残基配位结合(PstA的Arg220和PstC的Arg237),这些残基与PstS的磷酸盐结合位点共同决定了PstSCAB对磷酸盐的特异性。结合ATP酶活性测定、分子动力学模拟等,该研究揭示了PstSCAB的Pi特异性识别与转运分子机制,为靶向PstSCAB的病原菌防治药物研发提供了重要支撑。
ky开元集团助理研究员肖虎等为该论文的第一作者,陈庆锋研究员等为共同通讯作者。该研究得到了国家自然科学基金、云南省兴滇英才支持计划、云南省杰出青年科学基金、云南省应用基础研究基金、天津市杰出青年科学基金、云南大学“双一流”建设、昆明医科大学“皮肤黏膜再生医学”一流学科建设团队及深圳市科技计划项目等经费的支持。
全文链接:https://doi.org/10.1038/s41467-026-69153-1
